तापीय साम्य तथा ऊष्मागतिकी का शून्यवाँ नियम Thermal Equilibrium and Zeroth Law of Thermodynamics
तापीय साम्य तथा ऊष्मागतिकी का शून्यवाँ नियम (Thermal Equilibrium and Zeroth Law of Thermodynamics)
यदि किसी ऊष्मागतिक निकाय के सभी भागों का ताप समान हो तथा यह ताप परिवेश (surroundings) के ताप के बराबर हो तो निकाय को तापीय साम्य में कहा जाता है। यदि निकाय के विभिन्न भागों का साथ समान नहीं है तो निकाय की ऊष्मागतिक अवस्था में तब तक परिवर्तन होगा जब तक कि तापीय साम्य (thermal equilibrium) की अवस्था प्राप्त नहीं हो जाती।
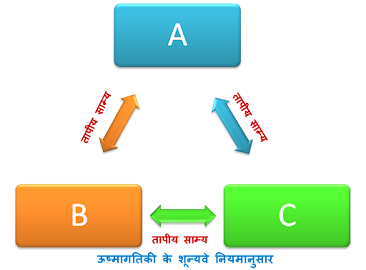
माना कि दो निकाय A व B है, जो एक-दूसरे से एक रुद्घोष दीवार (जिससे होकर कोई ऊष्मा नहीं गुजर सकती) से पृथक हैं। ये दोनों निकाय एक तीसरे निकाय C से एक उष्मीय चालक दीवार द्वारा सम्पर्क में है। अब निकाय A, निकाय C के साथ तापीय साम्य में होगा तथा इसी प्रकार निकाय B भी निकास C के साथ तापीय साम्य में होगा। यदि व B के बीच की रूद्धोष्म दीवार के स्थान पर उष्मीय चालक दीवार लगा दी जाय, तो प्रयोगों द्वारा यह देखा जाता है कि निकाय A व B की ऊष्मागतिक अवस्था में कोई परिवर्तन नहीं होता है।
अर्थात् A भी निकाय B के साथ तापीय साम्य में है। इस प्रकार यदि दो निकाय किसी तीसरे निकाय के साथ अलग-अलग तापीय साम्य में है, तब उन्हें एक-दूसरे के साथ भी तापीय साम्य में होना चाहिये। इस कथन को ऊष्मागतिकी का शून्यवा नियम कहते हैं। इस नियम से ताप को परिभाषा प्राप्त होती है।
ऊष्मागतिक निकायों का एक ऐसा गुण होता है जो उन्हें एक दूसरे के साथ तापीय साम्य में बनाये रखता है। इस गुण को "ताप" है। अतः ऊष्मागतिकी के शून्यवें निगम से ताप की परिभाषा इस प्रकार दी जा सकती है किसी निकाय का ताप वह गुण है जो यह ज्ञात कराता है कि वह निकाय अन्य समीपवर्ती निकायों के साथ तापीय साम्य में है अथवा नहीं क्योंकि यदि दो निकाय तापीय साम्य में हैं तो वे एक ही ताप पर होंगे। परन्तु यदि दो निकाय तापीय साम्य में नहीं है तो के भिन्न-भिन्न तापों पर होंगे।
निकाय द्वारा तथा निकाय पर किया गया कार्य
(Work done by and on the system)
किसी सिलेण्डर में भरी गैस के फैलने पर इसके द्वारा बाह्य दाब के विरुद्ध पिस्टन को बाहर धकेला जाता है और इस प्रकार गैस (निकाय) द्वारा पिस्टन (परिवेश) पर बाह्य कार्य किया जाता है। यदि बेलन में भरी गैस को पिस्टन द्वारा अन्दर की ओर धकेल कर संपीडित किया जाए, तो पिस्टन द्वारा गैस (निकाय) पर बाह्य कार्य किया जाता है।
 |
| गैस का प्रसार |
चित्रानुसार माना पिस्टन पर कुछ भार रखे हैं। माना पिस्टन पर से कुछ भार कम किया जाता है जिससे अन्दर मौजूद गैस का प्रसार होगा एवं गैस पिस्टन को ऊपर धकेलेगी जिससे बाह्य दाब के विरुद्ध गैस के द्वारा कुछ कार्य किया जायेगा।
माना पिस्टन के अनुप्रस्थ काट का क्षेत्रफल A तथा गैस का प्रारंभिक दाब P है। इस स्थिति में गैस द्वारा पिस्टन पर लगने वाला
बल =दाब × क्षेत्रफल
=P×A भार हटाने पर पिस्टन का विस्थापन ∆x हो तो गैस के आयतन में वृद्धि ∆V
= A×∆x होगी।
इसके लिए गैस द्वारा किया गया कार्य
∆W= बल× विस्थापन
= F x ∆x.
= (PA)×∆x
= P(A∆x)
= P×∆V
अब यदि दाब P पर गैस का आयतन V1 से बढ़कर V2 हो जाता है तो गैस (निकाय) द्वारा किया गया कुल कार्य
W= Σ∆W
जहां dV आयतन में सूक्ष्म वृद्धि है।
इसी प्रकार, भार बढ़ाने पर दाब P पर गैस के आयतन में ∆V की कमी होती है तो गैस (निकाय) पर किया गया कार्य
∆W=- P×∆V
यदि दाब P पर गैस आयतन V1 से घटकर V2 हो जाता है तो गैस (निकाय) पर किया गया कार्य
W= Σ∆W
यहाँ ∆V आयतन में सूक्ष्म कमी है।
यहां ध्यान रखना है कि गैस के प्रसार में बाह्य दाब के विपरीत गैस (निकाय) द्वारा कार्य किया जाता है तथा इस कार्य को धनात्मक मानते हैं, लेकिन गैस (निकाय) के सम्पीडन में पिस्टन द्वारा गैस पर कार्य किया जाता है तथा इस कार्य को ऋणात्मक मानते हैं।





Post a Comment